日前,由郑州大学第五附属医院、未知君、耀速科技组成的联合科研团队,在国际知名期刊 Genomics, Proteomics & Bioinformatics (GPB,五年平均影响因子9.1,JCR Q1区)发表最新合作科研成果。
在题为《Multi-Omics Study Reveals the Role of Tumoral Bacteria with Immune Environment in Gastric Carcinogenesis(编者译:多组学研究揭示了肿瘤细菌与免疫环境在胃癌发生中的作用)》的文章中,三方团队整合了微生物/代谢/蛋白的多种组学特征,揭示了胃癌肿瘤内细菌群落、代谢物与蛋白质在胃癌发生、发展中形成的复杂互作网络,为理解肿瘤微环境与微生物组的协同致病机制提供了新视角。
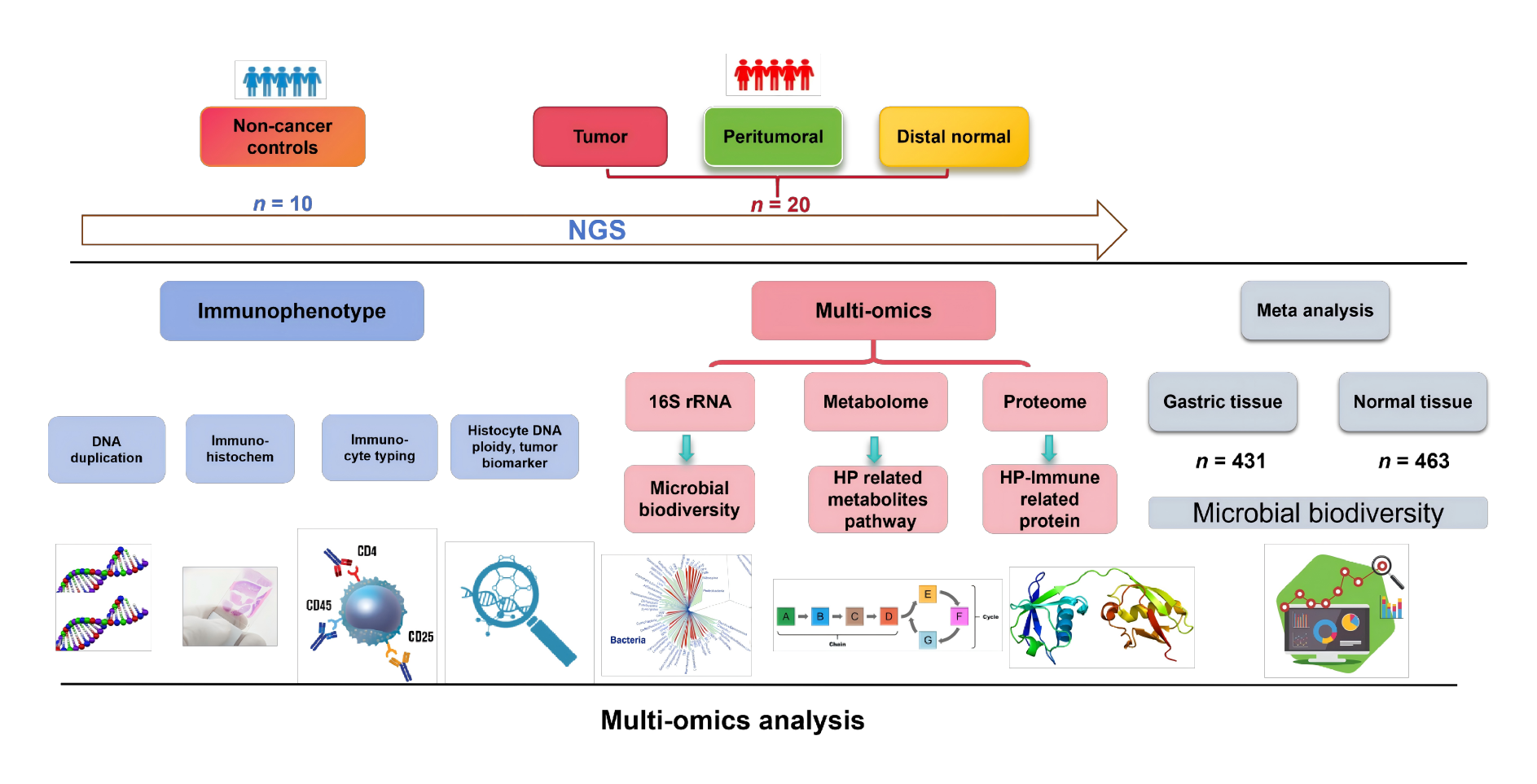
胃癌(GC)是一种多因素疾病,其发病原因涉及遗传背景、饮食习惯、免疫功能及慢性胃病等等因素,患者5年生存率仅约25%,并且一旦发生腹膜转移,生存率更是降至不足5%。已有研究发现,肿瘤组织内特定的细菌(瘤内菌)与致癌作用存在显著关联,其中部分病原菌已被证实是包括胃癌在内的多种癌症的促癌因子。同时,肿瘤微环境因免疫监视能力的减弱及营养物质的富集,也为特定细菌的定植提供了理想“居所”。因此,深入研究瘤内菌功能,及其与微环境的互作机制,对开发靶向治疗策略以及构建抗癌工程菌株具有十分重要的意义。
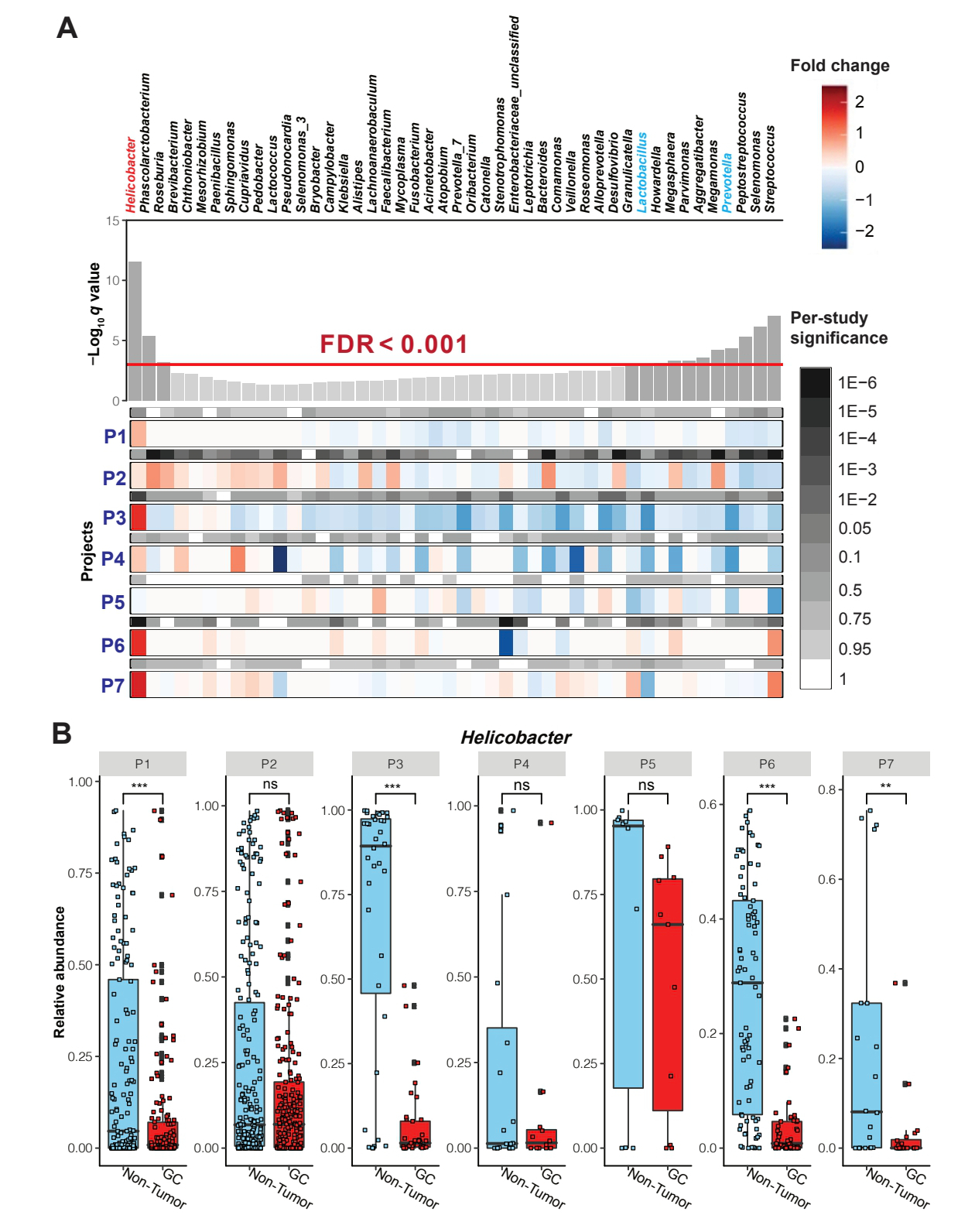
在本次见刊的研究中,科研团队采用了微生物组、代谢组、蛋白质组多组学整合的策略,对胃癌患者的肿瘤/非肿瘤配对样本进行了系统分析。首先为了探究不同胃肿瘤微环境中瘤内菌群的组成,研究者分别对癌组织、癌旁组织、非癌组织样本进行了基于16 S rRNA全长的微生物组学三代高通量检测。为了验证和表征不同样本中菌群的差异现象,研究者同时选择使用六个公共数据集进行荟萃分析以提取更加稳健的微生物信号。研究发现,胃癌肿瘤组织内的细菌多样性显著高于癌旁组织和健康组织。特别值得注意的是,像乳酸杆菌属(Lactobacillus)、普雷沃菌属(Prevotella) 等细菌在肿瘤组织中明显增多,而公认的胃癌风险因素幽门螺杆菌(Hp) 则在癌旁和非癌组织中更为富集。这表明肿瘤微环境可能“筛选”了特定的菌群。
由于肿瘤与非肿瘤组织中的细菌组成存在差异, 且这些组织具有不同的代谢状态,因此,研究团队利用质谱手段,进一步检测了这些组织在代谢和蛋白层面的信息。结果表明,与其他组织相比,犬尿氨酸(kynurenine)这种代谢物在肿瘤组织中显著富集。既往研究发现,犬尿氨酸与免疫抑制有关,它的积累可能帮助肿瘤逃避免疫系统的攻击。而在蛋白方面,研究者共鉴定出39种与宿主免疫相关的蛋白质,特别是在肿瘤组织中富集的色氨酸代谢途径。通过进一步对各个组间的差异蛋白进行深入的功能分析和代谢通路网络映射,研究者们提出了这样的假设:肿瘤组织与非肿瘤组织之间细菌群落的差异,可能会影响宿主免疫系统中的色氨酸代谢,从而导致相关代谢物的变化,这可能与肿瘤的发生和发展有关。
随后,研究团队整合了各个组学数据,构建了一个复杂的调控网络,鉴定出了胃癌瘤内微生物、蛋白质和代谢物之间的潜在关系,例如,肿瘤中富集的某些细菌(如 Brevundimonas nasdae, Brevundimonas vesicularis, Bacteroides thetaiotaomicron )与犬尿氨酸水平升高和免疫抑制性蛋白表达相关联。而幽门螺杆菌则与免疫调节性T细胞(Tregs)增多有关,这些为开发新的生物标志物和治疗靶点提供了理论基础。
本研究的重要意义在于系统阐明了胃部肿瘤内细菌群落、宿主代谢重编程(特别是色氨酸-犬尿氨酸通路)和免疫抑制微环境三者之间的复杂相互作用,为理解胃癌发生提供了更全面的微生物学视角;鉴定出的差异菌群、关键代谢物(如犬尿氨酸)和免疫相关蛋白,为未来开发胃癌的早期诊断生物标志物和新型治疗靶点(如调控菌群、阻断犬尿氨酸通路)奠定了重要基础;研究发现的具有潜在关联的特定菌株,未来有可能被开发成新一代的益生菌制剂或基于菌群的创新药物,用于胃癌的预防或辅助治疗。
本次研究的成功得益于三方核心优势的深度融合,其中,郑州大学第五附属医院马歇尔医学研究中心凭借其在胃癌领域深厚的临床经验与科研实力,为研究提供了坚实的医学基石;未知君则贡献了其在人体共生菌群方面海量的专有数据与前沿的科研积累,精准锁定了研究方向,和耀速科技共同承担了关键的临床数据多组学分析任务,后者以其强大的生物信息学能力将复杂的生物数据转化为深刻的洞见。
这项成果不仅深化了科学界对胃癌微生物病因的认识,也为全球微生物制药领域的科研人员和企业筛选具有治疗潜力的功能菌株、开发创新型胃癌诊疗方案,提供了重要的理论依据和转化方向。
-End-