日前,未知君与北京大学肿瘤医院沈琳教授的联合科研团队再传捷报——双方合作的研究成果《Impact of Helicobacter pylori Infection on Gut and Intratumoral Microbiome and Its Association with Immunotherapy Response in Gastrointestinal Cancer(幽门螺杆菌感染对胃肠道癌症患者肠道及肿瘤内菌群的影响及其与免疫治疗应答的相关性)》在知名期刊BMC Medicine(JCR Q1,中科院1区,IF8.3)正式发表,该研究有望从底层科学机制出发,提升胃癌免疫治疗的准确性与科学性。

幽门螺杆菌感染与胃肠道肿瘤发生密切相关,但其对免疫治疗结局的具体影响一直缺乏系统证据。此前,沈琳教授团队在一项独立研究中发现,幽门螺杆菌阳性可通过塑造 “热肿瘤”微环境,显著延长 EB 病毒阴性且微卫星稳定型胃癌患者的免疫治疗生存期(引自:https://doi.org/10.1016/j.xinn.2023.100561)。在本次合作研究中,双方团队从肠道菌群和瘤内菌群切入,对这一现象背后的微生物机制进行了进一步探索。
研究共收集400多名不同癌症类型、不同临床结局患者的粪便和肿瘤样本,分析肠道菌群与肿瘤内菌群特征;评估了在肠道和肿瘤组织中的微生物组成及其多样性,并将其与临床结局进行关联分析,探究幽门螺杆菌感染状态、菌群结构改变与免疫治疗疗效,三者之间的关系,为幽门螺杆菌感染与胃癌患者免疫治疗疗效增强的关联性,提供了全新的机制解释。
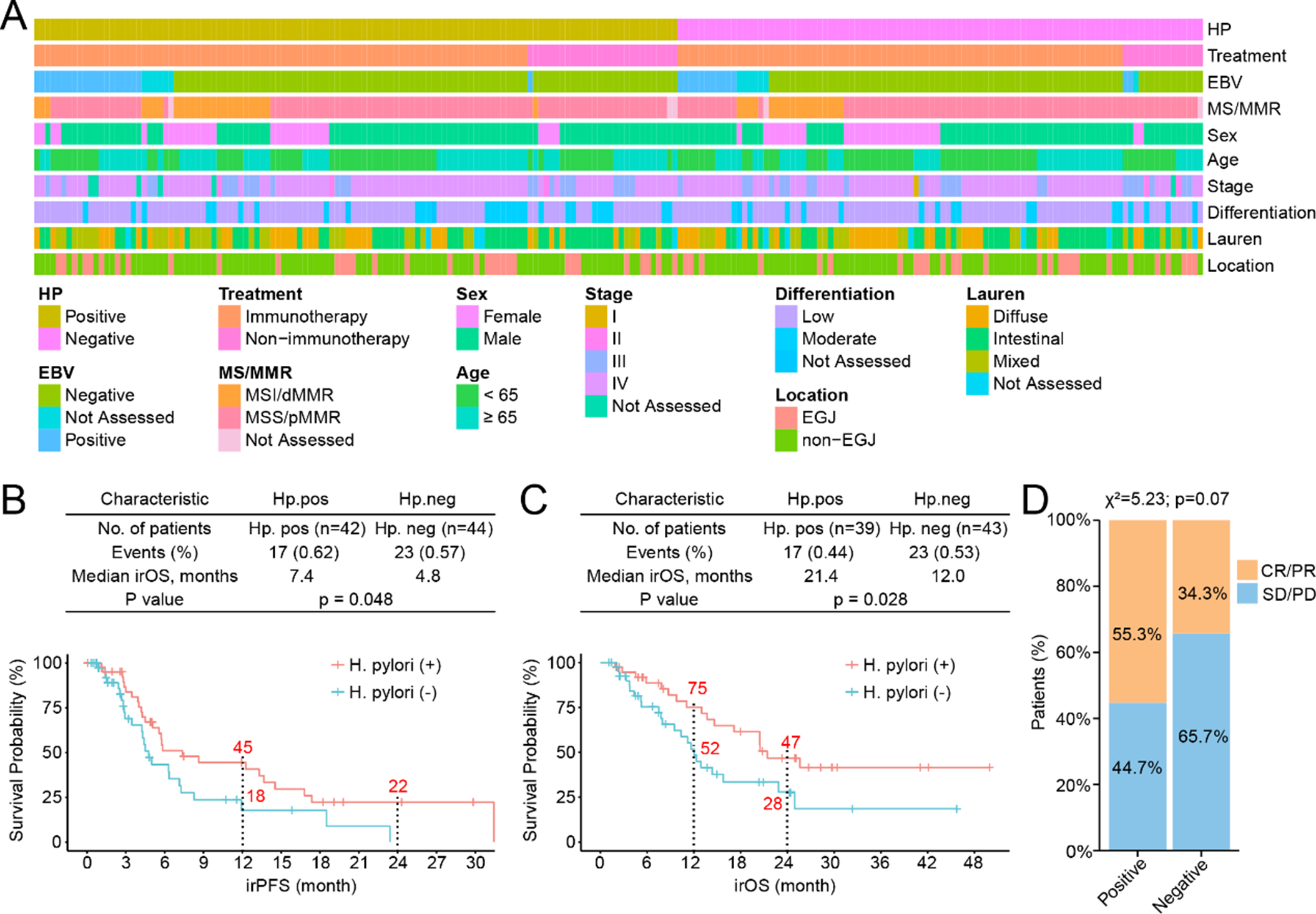
胃癌(GC)患者队列的特征以及幽门螺杆菌(H. pylori)感染状态对生存期和免疫治疗反应的影响
研究者指出,幽门螺杆菌阳性患者的肠道菌群表现出更高的多样性以及独特的菌群特征,并且这些特征与接受免疫治疗后的无进展生存期和总生存期的长短相关。以上结果说明,幽门螺杆菌阳性的胃癌患者对免疫治疗更加敏感。
为了明确肠道菌群介导幽门螺杆菌感染影响免疫治疗疗效的潜在机制,研究者进一步探索了肠道菌群丰度、幽门螺杆菌感染状态与免疫相关无进展生存期的关联性。通过对EB 病毒阴性且微卫星稳定型胃癌患者的粪便样本进行宏基因组菌群分析,研究者发现幽门螺杆菌阳性(后简称:HP+组)和阴性组(后简称:HP-组)之间有45种肠道微生物具有显著差异;其中,Clostridium leptum, Oscillibacter sp. ER4, Ruminococcus bromi等物种在HP+组中显著富集,同时这些菌种与免疫治疗应答改善相关。
为清晰阐释以上45种差异菌种的整体特性,研究者对HP+组与HP-组患者分别进行了系统分析。结果显示,幽门螺杆菌感染会显著改变肠道菌群的相互作用模式,尤其是Eubacterium ramulus这一物种的中介中心性指标在两个组间存在显著区别。这说明,在HP+组患者的肠道菌群中,Eubacterium ramulus承担着关键的 “桥梁介导” 作用,负责连接不同菌群间的相互作用;而在HP-组患者的肠道菌群中,该细菌并未呈现出此类核心介导功能。HP+组患者的肠道菌群中精氨酸生物合成通路增强。
联合研究团队同时应用了16S全长测序技术来研究瘤内菌的组成,该技术可以将测序序列准确地鉴定到“种”水平,实现精细物种鉴定,真实还原微生物群落组成,在菌群研究中具有明显优势。研究者发现,在HP-组中,Streptococcus和Granulicatella两个菌属明显富集;HP+组中,L-赖氨酸向乙酸盐、丁酸盐发酵的通路明显富集。已有研究表明,丁酸盐可促进细胞代谢并增强活化CD8⁺T细胞的记忆潜能,为免疫治疗应答提供了潜在机制支撑。
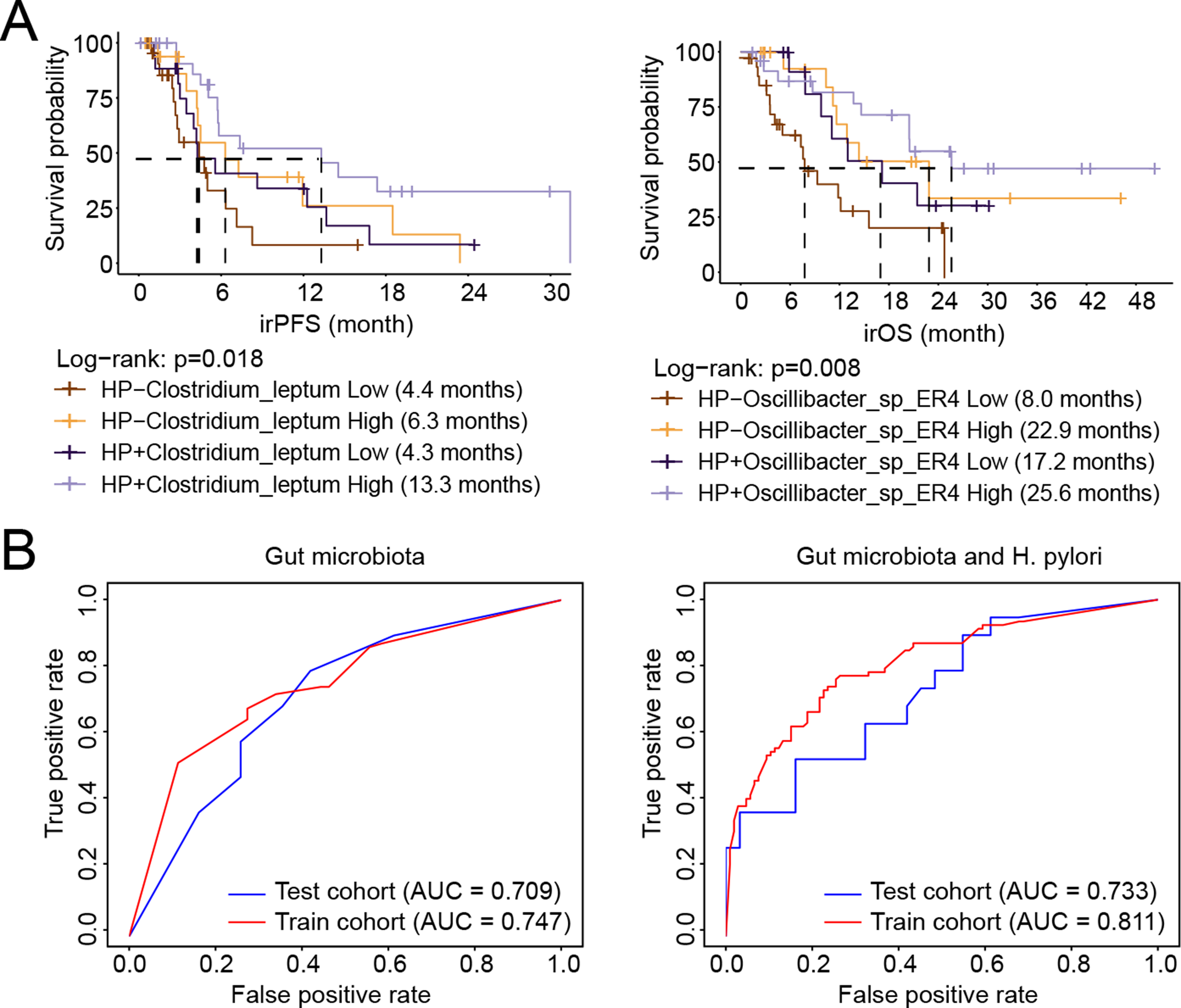
结合幽门螺杆菌(H. pylori)感染状态与肠道微生物组特征以区分免疫治疗反应
在联合研究团队已明确幽门螺杆菌感染影响免疫治疗疗效的基础上,未知君依托领先的 AI 微生物组研究平台进行了机器学习建模,将幽门螺杆菌感染状态纳入预测模型,使得对胃癌免疫治疗结局的预测准确性得到进一步提高,为未来实现基于微生物特征的个体化免疫治疗策略提供了重要方法学支撑。
多年来,北京大学肿瘤医院始终坚定选择未知君作为学术研究的战略合作伙伴,双方已在多项国际知名期刊上发表重要成果。此次携手“再下一城”,不仅在技术层面集中展现了未知君“AI+BT”创新平台在微生物组研究中的关键支撑作用;在临床与转化层面,也是在自研菌株 XA‑511 获得国家发明专利之后,未知君在肿瘤活体微生物药领域迈出的又一重要里程碑。
随着相关研究不断深入,肠道微生物正逐步从“旁观者”走向“参与者”,有望成为未来肿瘤精准诊疗体系中不可或缺的新型治疗支点。
-End-